药品作为一种特殊商品,其安全、有效、质量可控与公众健康密切相关,各国政府均对其实行严格的监管措施。[1]其中,药品上市前的技术审评结论将作为后续监管措施的基础和依据,其科学、高效与否关系到公众用药的安全性和可及性。[2]因此,药品注册和相应的技术审评制度几乎构成了各国药品监管的核心。[3]然而我国药品技术审评工作的整体状况还不尽如人意,审评人员不足、审评资源匮乏等情况突出,且短期内难以彻底解决,审评时滞、申请积压等现象严重,遭到社会各界的诟病。在当前药品审评制度改革正在开展之际,通过构建科学完善的药品审评质量管理规范(Good review practice, GRP)体系以整合资源、 优化流程、提高药品审评质量和效率,不失为一种有效的探索。美国作为世界上药品监管水平较高的国家,其GRP体系经过近20年的发展已较为成熟。因此,本文详细介绍美国GRP的相关情况以期对完善我国药品审评质量管理规范提供借鉴。
1992年,美国国会通过了《处方药申报者付费法案》(The Prescription Drug User Fee Act,PDUFA),授权美国食品药品监督管理局(Food and Drug Administration, FDA)向药品申报者收取相应费用。FDA将相当部分的新增资源用于雇佣审评人员,仅在PDUFA I(PDUFA第一次获得授权)期间,FDA新药审评人员①从1992年的1 277人增加到1997年的1 990人。[4]之后,如何更好地保证审评质量、提高审评效率成为FDA面临的新问题。此外,FDA针对当时药品审评工作虽然出台了诸多指南,但大多是对申请人提出各类建议或要求,缺乏对药品审评机构和药品审评人员的具体要求和规范。这使得FDA的审评工作程序不够明确、透明,弱化了申请人在审评过程中的参与和监督作用。同时,审评报告也普遍存在内容、格式等方面的不统一、不规范现象,导致申请资料总结不准确、遗漏关键信息、可读性差、结构化差异明显等问题。[5]监管部门逐渐开始意识到这一问题,药品审评和研究中心(Center for Drug Evaluation and Research, CDER)与生物制品审评和研究中心(Center for Biologics Evaluation and Research, CBER)于1996年共同提出了GRP的概念,旨在弥补这一监管的缺失。[6]
① 这里的新药审评人员指的是药品审评和研究中心(CDER)、生物制品审评和研究中心(CBER)、监管事务办公室(ORA)以及专员办公室(OC)从事药品审评工作的人员。
在GRP概念提出初期,其发展缓慢,最初几年仅颁布了四项指南。[6]直至2005年4月,CDER和CBER根据PDUFA III(PDUFA第三次获得授权)的目标要求制定了《审评人员和企业指导原则——PDUFA产品的药品审评质量管理规范与实践》(Guidance for Review Staff and Industry-Good Review Management Principles and Practices for PDUFA Products,GRPMs),该指导原则在后续工作中发挥了指导性作用。[7]之后,GRP进入快速发展期。2007年,《21世纪CDER审评程序参考指南》(The CDER 21st Century Review Process Desk Reference Guide,DRG)发布,提供了更多与GRMPs所规定的审评活动和时限相一致的信息,GRP体系更加趋于完善。[8]
目前,经过近二十年的发展,美国FDA已经颁布了总则、生物统计、临床试验、临床药理、药理毒理、药物安全性等多学科类别的指导性文件,基本形成了一个较为完整的GRP体系,成为美国药品监督管理工作的重要组成部分。
药品审评质量管理规范是基于FDA长期以来审评实践的丰富经验而制定的。指导性文件构成了这一体系的主体。这些指导性文件以“质量、效率、明确、透明、一致”为核心价值,规定了药品审评过程中审评机构和审评人员的法定职责以及如何更加高效、科学地履行这些职责。[6] GRP体系的指导性文件涉及药品和生物制品审评过程、审评管理和审评报告格式、内容等多个方面,覆盖药学、临床、药理、毒理等多个学科,贯穿申请提交前、受理及审评计划制定阶段、专家咨询会议阶段、审评阶段、审评结论阶段、审评结论后阶段等各个审评阶段,体系庞大。文件类型包括供企业和审评人员使用的指导原则,如上述的GRMPs等; CDER制定的政策及程序手册(MAPP),
如《药品审评质量管理规范:统计审评模板》等;CBER制定的标准操作规程及政策手册(SOPP),如《生物制品许可证(BLA)申请的管理流程》等。[9, 10]这些指导性文件分别由CDER和CBER的相关办公室编写,提供了有关CDER和CBER的具体工作流程、审评人员工作要求以及给企业的建议等细节。
在GRP概念提出前,早期的FDA药品审评过程中药品审评人员的工作职责、工作程序以及审评活动中积累的知识和经验并未明确地以文字形式记录下来。[6]药品审评质量管理规范正是致力于将审评过程中积累的现有知识、经验进行系统化、书面化,对审评过程进行规范化,以到达双重目标[7]:即一方面保证药品审评质量,另一方面提高药品审评效率。
为达成上述目标,GRP提供了诸多措施,包括明确了在做出监管决策之前必须完成的关键审评步骤和相应时限,出台指导原则和审评模板以保证审评过程、审评关注点以及审评报告格式的一致性,重视培训和绩效评 估以推动GRP的贯彻实施和持续改进。 这些措施共同彰显了GRP的核心价值——质量、效率、明确、透明和一致,既保证了审评过程和审评管理的质量和一致,又提高了审评过程和审评管理的效率、清晰度和透明度。[11]
时限制度通过对药品审评过程中的审评人员和申请人的行为给予时间上的限制,可以有效保障审评效率和申请人合法权益。[12] FDA估计,审评完成每提前1个月,生产商的平均成本节约1千万美元。[13] GRMPs系统梳理了整个药品审评过程,将药品审评过程分为受理和审评计划、审评、咨询委员会会议、审评结论和审评结论后五个阶段,将涉及到的审评活动细分为41个关键事项,明确规定了相应的完成时限,并指定了负责部门和个人。
以受理和审评计划阶段为例(表1),GRMPs规定了文件管理部门、项目经理以及审评小组成员需要完成的关键事项和相应时限,如应在接收申请材料后的14天内,指定项目经理,开始立卷审查,发出申请受理书面通知,指定审评小组。明确细致的工作内容、审评时限以及责任主体为审评人员提供了行动指南,也使申请人及时掌握审评动态、实时监督审评进程,进而提高药品审评工作的质量和效率。
药品审评工作作为一项高度智力化的活动,具有很强的灵活性和主观性,然而审评结果的一致性和客观性又是我们追求的目标。面对这一矛盾,GRP提供了各专业审评的模版,并细分为不同申报情况下的撰写要求,分别指导相应学科的专业审评工作。审评模板尽可能将审评过程中的共性部分实行严格控制,以保证审评过程的一致性。
这些审评模板明确了审评过程中应关注哪些资料,如何将相关技术考虑体现在审评报告中,如《药品审评质量管理规范:统计审查模板》用于记录生物统计学室(OB)对 新药上市申请(New drug applications, NDAs)和生物制品许可申请(Biological License Applications, BLAs)的初步统计审评结论,规定审评报告应包括执行概要、引言、统计评价、特殊人群/亚组人群的发现、总结和结论等部分,并详细说明了各部分所占篇幅、撰写规范和要求等,细致且可操作性较强。[15]
一般情况下,这些审评模板在各专业审评过程中是强制执行的,为了适应特殊事项或特定程序,各临床审评部门可对模板进行修改。然而,这些修改必须在整个部门做到标准化、一致化,在模板更改控制委员会备案,并且将其作为原文件的修订版执行。[16]
任何改革政策的推行都不是一蹴而就的,仅制定一套药品审评质量管理规范无法立即带来正面的变化,还需要不断的相关培训和绩效评估改进,方能贯彻实施和持续改进。[7]
FDA的培训包括专业素质培训和共性能力培养,前者包括药学、临床、药理毒理、法律法规等专业知识培训;后者包括分析比较能力、审慎思考能力、沟通交流能力、处理分歧能力等培养。[5]另外FDA还经常性地组织各类内外部交流活动,讨论学习、共享经验,并形成记录资料供工作人员随时学习。
为评估GRP的实施情况并进行持续改进,GRP规定应定期进行绩效评估。如2011年,FDA曾委托博思艾伦咨询公司(Booz Allen Hamilton)通过审阅审评记录考察61项NDAs和BLAs的审评过程中审评人员对GRMPs所规定的41项关键活动和相应时限的遵从情况。同时结合与监管项目经理、一线审评人员和申请人代表的访谈、FDA工作人员问卷调查,分析可能影响GRP贯彻实施的因素,并给出相应的改善建议。[14]
美国GRP经过近二十年的发展,其对药品审评工作的影响日益凸显,基本实现了政策初衷,在保证
药品审评工作质量,确保拟批准上市药品安全、有效、质量可控的前提下,大幅缩短了药品审评时间、显著提高了首轮药品批准率。
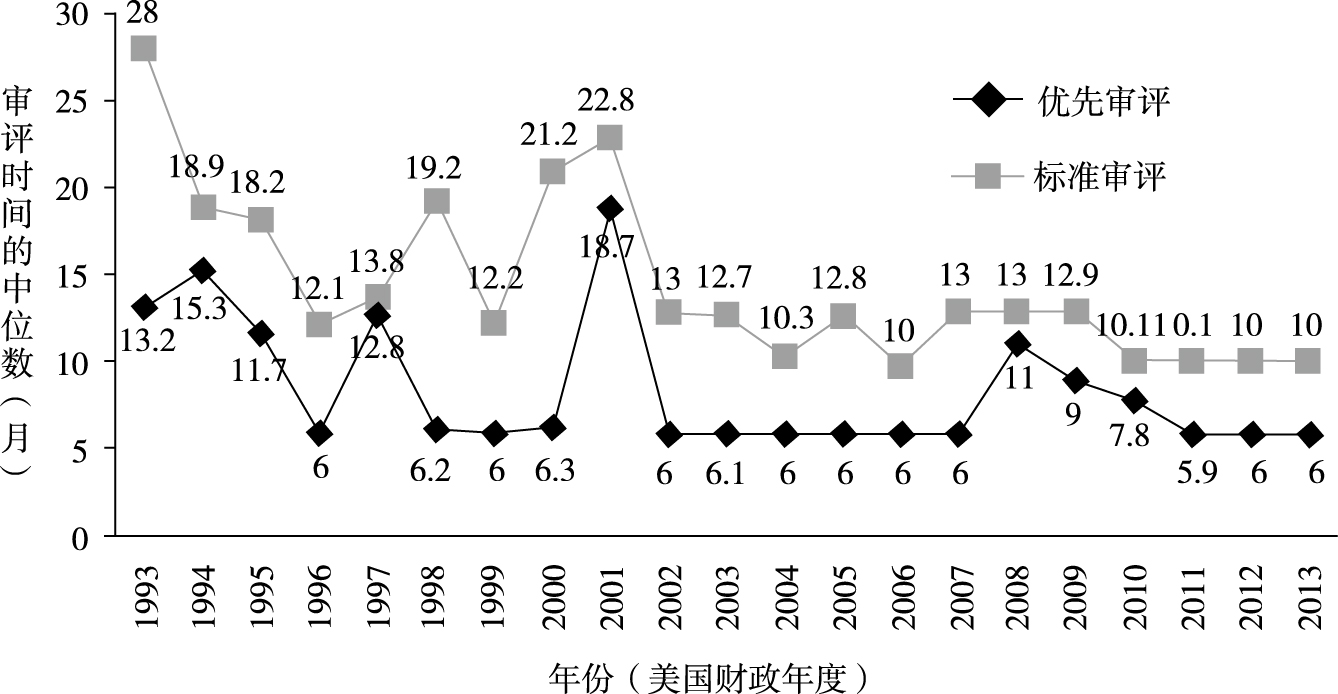
药品审评时间作为药品审评工作的一项重要指标,可以反映药品审评工作的成效,也是GRP实施效果的直观体现。[17]从图1可以看出,从1996年起,除少数年份外,美国CDER和CBER对NDAs和BLAs的审评时间整体大幅缩短:1993年标准审评时间中位数为28个月,优先审评时间中位数为13.2个月,1996年GRP施行后,标准审评时间中位数下降至12.1个月,优先审评时间中位数降至6个月,2013年标准审评时间中位数降至10个月、优先审评时间中位数保持在6个月。
如图2所示, CDER和CBER的NDAs和BLAs的首轮药品批准率从1993年的36%升至1996年的50%,近几年稳定保持在70%~75%之间。博思艾伦咨询公司通过对185项新药申请(这些申请均是于2002—2007年接收且在2007年9月30日前做出审评结论,其中NDAs占74%,BLAs占26%)的审评过程和审评 结论进行相关性分析发现, 首轮药品批准率与审评过程中审评人员对GRMPs所规定的关键事项及相应时限的遵从率①正相关:遵 从率为80%的新药申请,其首轮药品批准率为71%, 而遵从率为20%的新药申请的这一比例仅为50%。[20]由此可见,明确并遵守药品审评过程的关键事项和相应时限,有利于提高首轮药品批准率,减少药品审评周期数,从而提高药品审评效率。
① 遵从率指一项新药审评过程中,审评人员在规定时限内完成的关键事项数与GRMPs规定的关键事项总数(41项)的比值。
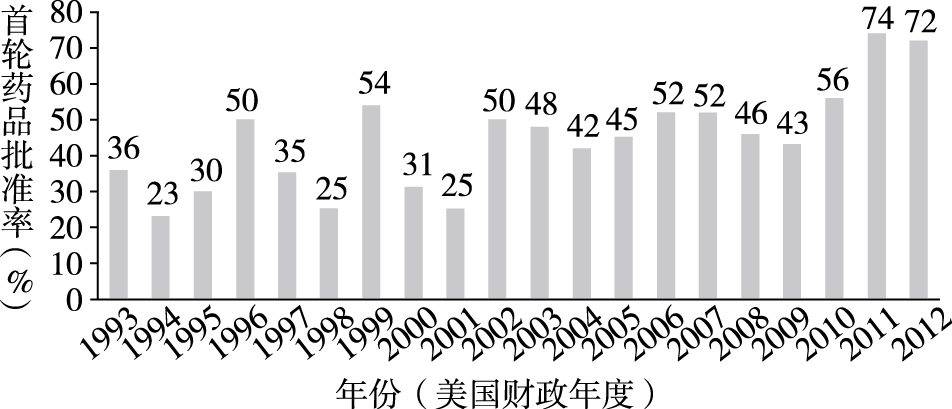
| 图2 1993—2013年CDER和CBER的NDAs和BLAs首轮药品批准率[18] |
近年来,国家食品药品监督管理总局药品审评中心根据《行政许可法》、《药品注册管理办法》等法律法规的要求,结合药品审评工作实际,出台了诸多规范。2011年出台的《药品技术审评原则和程序》,为药品审评工作和制度规范化建设提供了依据,并就构建我国药品审评质量管理规范体系提出了要求。[21]随后,药品审评中心先后制定并出台了《药品审评中心审评任务管理规范(试行)》和《药品审评中心技术审评决策路径管理规范(试行)》等一系列规范性文件。[22]较之以往,我国药品审评工作更加公开、透明、科学、民主。但是目前我国药品审评质量管理规范体系尚未完全建立,还存在诸多不足。主要表现在以下几个方面:
第一,我国只笼统地规定了药品审评时限,一方面这些时限规定并不符合现实情况,另一方面缺乏详细的审评步骤和相应时限规定,导致这些笼统的时限规定难以落实,形同虚设,“审评超时”问题一直未能得到有效改善。使申请人不能清晰把握所申报品种的审评节奏,广大群众更是缺乏监督的具体量化标准。[23]
第二,我国药品审评中心虽然出台过审评报告撰写意见,但未体现科学、统一的审评原则和尺度,也未将审评过程中积累的经验标准化、制度化,导致审评报告完整性差、结构性差异明显,甚至因信息遗漏而导致出现审评质量问题。
第三,目前,我国药品审评部门的培训制度大多为短期、零散且不成体系。新的法律、法规出台后,也多以员工自我学习为主,这种方式不利于新政策的贯彻施行。
第四,我国药品审评质量管理规范没有相应评价体系,也未能及时更新,个别制度规范已不符合现实情况,某些新情况、新问题又无章可循,导致审评工作出现不同程度的管理风险,难以保证审评工作的科学性、规范性和一致性。
审评时限是药品技术审评工作的重要内容,也是申请人和社会各界非常关注的问题。我国2007版《药品注册管理办法》第一百五十条规定新药临床试验申请和新药上市申请的标准审评时限分别为90日和150日,而《2013年度药品审评报告》统计数据显示,两者的实际审评时间分别为9个月和19个月①,巨大的差距显示出我国药品审评时限规定的不科学、不合理。因此,应进一步完善我国药品审评时限规定,结合我国药品注册申请基数大、积压严重、审评资源匮乏的实际情况,修改相关法律法规中的时限规定,使之更加切实可行、科学合理。在此基础上借鉴美国GRMPs中的药品审评关键步骤和相应时限规定,结合我国药品审评工作实际,梳理审评流程、识别关键节点,细化时限规定。
① 新药临床试验和新药上市申请的实际审评时间是按药品审评中心系统显示的“等待时间”加上“法定审评时间”(以30天/每月计算)得到。
药品审评作为技术性、专业性、公共性服务行为,应体现科学、公平和一致,因此,制定规范化、可操作性强的审评模板至关重要。建议首先由各专业资深审评人员总结其在审评过程中积累的经验,明确审评关注点、审评原则和尺度以及审评报告应包括的内容等。然后按药品种类、申请类别、适应症等提炼并标准化这些最佳操作规范,制定或修订审评模板,使之反映药品审评规律且利于操作。在审评过程中,审评人员可就审评模板的适宜性进行讨论,也可听取申请人的建议,在实际操作中不断完善审评模板,使其更加科学、规范、可操作。
审评人员
培训是药品审评质量管理规范贯彻实施的重要途径,建议借鉴美国的培训经验构建系统、高效、统一、经济的药品审评人员培训模式。具体而言,培训内容应包括专业 知识培训、共性能力培训、 审评规范培训以及职业道德培训等。同时应加强培训工作的统一性,尤其是对法律法规、审评规范的培训。另外,可采用多元化培训形式,例如网络培训、“导师制”新审评人员培训等。
规范性文件的制定大多立足 于当时的现实情况, 随着社会政治经济条件的变化,必然会出现不再适用的部分。主管部门应尽快出台“制度文件的立、改、废工作指南”,定期对药品审评质量管理规 范体系中的指导性文件进行适用性评估和修订。另外, 应借鉴美国经验构建独立的追踪评价体系,及时发现制度实施中的问题,寻求持续改进。
| [1] | 韦冠. 国内外药品上市许可制度比较及借鉴[J]. 中国药房, 2008, 19(34): 2650-2653. |
| [2] | 武志昂, 毕开顺. 从市场经济角度看药品注册管理[J]. 中国药师, 2007, 10(5): 489-491. |
| [3] | Jason P, Peter D, Ian W. Medico legal Essentials in Heal-thcare[M]. Churchill Livingstone, 2004. |
| [4] | Office of Management and Systems of FDA. PDUFA III Five-Year Plan [EB/OL]. (2003-07-27) [2014-11-15]. http://www.fda.gov/downloads/ForIndustry/UserFees/PrescriptionDrugUserFee/UCM176324.pdf |
| [5] | 吕东, 陈晓媛, 黄文龙. 中美药品技术评价体系比较[J]. 中国新药杂志, 2009, 18(2): 98-104. |
| [6] | 宋华琳. 美国药品审评质量管理规范评介[J]. 药学进展, 1999, 23(6): 350-353. |
| [7] | CDER of FDA, CBER of FDA. Guidance for Review Staff and Industry:Good Review Management Principles and Practices for PDUFA Products [EB/OL]. (2005-03-15) [2014-11-15]. ghttp://www.fda.ov/downloads/drugs/guidancecomplianceregulatoryinformation/guidances/ucm079748.pdf |
| [8] | CDER of FDA. The CDER 21st Century Review Process Desk Reference Guide (DRG) [EB/OL]. (2014-09-10) [2014-11-15]. http://www.fda.gov/downloads/aboutfda/centersoffices/officeofmedicalproductsandtobacco/cder/manualofpoliciesprocedures/ucm218757.pdf |
| [9] | CDER of FDA. Good review practice [EB/OL]. (2013-12-02) [2014-11-15]. http://www.fda.gov/drugs/guidancecomplianceregulatoryinformation/ucm118777.htm |
| [10] | CDER of FDA. Biologics Procedures (SOPPs) [EB/OL]. (2010-05-19) [2014-11-15]. http://www.fda.gov/BiologicsBloodVaccines/GuidanceComplianceRegulatoryInformation/ProceduresSOPPs/default.htm. |
| [11] | Office of new drugs of FDA. Good review practices (MAPP 6025.1) [EB/OL]. (2012-03-02) [2014-11-15].http://www.fda.gov/downloads/AboutFDA/CentersOffices/OfficeofMedicalPr o ductsandTobacco/CDER/ManualofPoliciesProcedures/ucm082016.pdf |
| [12] | 宋华琳. 中国药品审评法律制度的行政法改革[J]. 行政法学研究, 2014(3): 3-12. |
| [13] | 姚立新, 李茂忠, 董江萍, 等. 从PDUFA I到PDUFA V——FDA通过法规体系的完善实现新药审评的持续改进[J]. 中国新药杂志, 2013, 22(10): 1143-1156. |
| [14] | Booz Allen Hamilton.Assessment of GRMPs Implementation [EB/OL]. (2011-04-29) [2014-11-15].http://www.fda.gov/downloads/forindustry/userfees/prescriptiondruguserfee/ucm272446.pdf |
| [15] | Office of Translational Sciences of FDA. Good Review Practice: Statistical Review Template (MAPP 6010.4)[EB/OL]. (2012-07-30) [2014-11-15]. http://www. fda.gov/downloads/aboutfda/centersoffices/officeofmedicalproductsandtobacco/cder/manualofpolicies- procedures/ucm313814.pdf |
| [16] | Office of New Drug of FDA. Good Review Practice: Clinical Review Template (MAPP 6010.3) [EB/OL]. (2010-12-10) [2014-11-15]. http://www.fda.gov/downloads/aboutfda/centersoffices/officeofmedicalproductsandtobacco/cder/manualofpoliciesprocedures/ucm080121.pdf |
| [17] | 董江萍, 刘璐, 张象麟. 中美两国药品注册工作时限管理的比较[J]. 中国新药杂志, 2005, 14(1): 4-7. |
| [18] | Jenkins J K. CDER New Drug Review:2012 Update [EB/OL]. (2012-12-10) [2014-11-29]. http://www.fda.gov/downloads/About%20FDA/Centers%20Offices/Office%20of%20Medical%20Products%20and%20Tobacco/CDER/UCM331454.pdf |
| [19] | FDA. FY 2013 Performance report to the president and congress for the Prescription Drug user Fee Act [EB/OL]. (2014-04-23) [2014-11-29]. http://www.fda.gov/downloads/AboutFDA/ReportsManualsForms/Reports/UserFeeReports/PerformanceReports/UCM384035.pdf |
| [20] | Booz Allen Hamilton. Independent Evaluation of FDA's First Cycle Review Performance-Final Report [EB/OL]. (2008-07-16) [2014-11-15]. http://www.fda.gov/downloads/ForIndustry/UserFees/PrescriptionDrugUs-erFee/ucm127982.pdf |
| [21] | 国家食品药品监督管理总局药品审评中心. 药品技术审评原则和程序[EB/OL]. (2011-03-23) [2014-11-30]. http://www.cde.org.cn/news.do?method=large- Info&id=312103 |
| [22] | 国家食品药品监督管理总局药品审评中心. 关于印发《药品审评中心技术审评决策路径管理规范(试行)》和《药品审评中心审评任务管理规范(试行)》的通知[药审业[2011]129号][EB/OL]. (2011-10-09) [2014-11-30]. http://www.cde.org.cn/regulat.do?method=largePage&id=2851 |
| [23] | 李艳坤, 邢花, 陈宇, 等. 刍议我国药品技术审评原则和程序的新变化[J]. 中国新药杂志, 2012, 21(10): 1073-1075. |
(编辑 刘 博)