2015年5月5日,国家发展改革委等七部委联合发文,决定推进药品价格改革,取消绝大部分药品政府定价,逐步建立以市场为主导的药品价格形成机制,最大限度减少政府对药品价格的直接干预。政策的出台表明我国未来将通过衔接招标采购和医保控费政策,建立医保支付标准来深入推进药品价格改革。而依据参考价格体系来制定医保支付标准早已在多数国家和地区付诸实践,且被证明是一种行之有效的支付标准管理方式。德国作为世界上首个建立参考价格体系的国家,其参考价格体系科学成熟,设计精辟完备,众多国家纷纷效仿。因此,本文对德国参考价格体系进行系统性梳理,以期对构建我国医保支付标准提供借鉴。
德国于1883年制定了《医疗保险法》,建立了法定医疗保险制度,旨在向民众提供补偿范围广且低廉的医疗服务,降低被保险者的医疗负担,但这不可避免地刺激了医药费用的增长。为了有效控制医药费用的过快增长,德国相继实施了价格折扣、参考价格、医药费用分担等制度,并取得了显著成效。[1]其中,为达到长期控制药品费用的目标,德国于1989年实施《医疗改革法案》,率先在其法定医疗保险系统中构建了融合定价与补偿的支付标准制定方法——参考价格体系。该体系对降低药品价格起到了积极作用,并随后在荷兰、丹麦、瑞典、西班牙、比利时、意大利、澳大利亚、新西兰和加拿大等国广为应用。
参考价格体系通过限制药品补偿水平进而间接控制药品价格,其设计的主要理念为一方面增加患者和医生对药品价格的敏感程度以提高药品价格的需求弹性,降低需方对药品的需求量,避免道德风险行为;另一方面促使供方为避免失去市场份额而自觉限制药品价格,增强供方市场的竞争,最终降低保险者支付的药品费用。[2]参考价格体系有5个显著特点:(1)依据生物等效性或治疗等价性对药品进行分组;(2)参考价格是每组药品补偿上限;(3)参考价格根据药品市场价格分布状况制定;(4)厂商自由定价;(5)如果厂商定价高于参考价格,患者需支付差额。[3]在德国参考价格制定过程中,首先由联邦联合委员会(G-BA)依据分组标准将药品划分为不同的参考价格组并确定药品限定日剂量和比较大小(VG),然后由联邦医疗保险基金协会(GKV-SV)制定各分组的最高补偿额并由德国医学文献和信息研究所(DIMDI)将参考价格信息在网上公布,便于相关主体进行查阅与监督。[4]目前德国药品市场上大约75%的处方药[5]和部分非处方药受到参考价格体系的管理。
德国在制定药品价格过程中充分体现了分类管理的思想。首先将药品划分为不予补偿的药品和可补偿药品。其中不予补偿药品由厂商自由定价,可补偿药品依据有无创新性划分为创新药品和非创新药品。创新药品依据药品的附加效益程度由保险者与厂商协商制定价格,如果协商不能达成共识,则交由仲裁机构(包括基金协会代表、厂商代表、中立成员)裁决。非创新药品则纳入参考价格体系,由厂商自由定价,但受到参考价格的约束。因此参考价格体系包括了绝大多数的可补偿药品以及不具备创新性的专利药品。
可补偿药品——绝大多数纳入参考价格体系。德国实施负面清单(negative list)制度,一般而言,获得上市许可的药品都可获得补偿,除非药品被纳入负面清单。负面清单包括四种药品类型:(1)用于治疗轻微症状的药品;(2)“无效益”(inefficient)的药品;(3)“life-style”药品,主要用于改善生活品质;(4)非处方药品(部分除外)。其中第一类药品于1983年未纳入补偿,第二类药品于1991年未纳入补偿,“life-style”药品及非处方药于2004年被列为不予补偿药品。[6]
专利药品——无疗效改善的药品将纳入参考价格体系。2004年德国实施《健康保险现代化法案》规定可以将专利药品纳入参考价格体系中,但不包括那些与现有治疗方案相比具有疗效改善的药品。2011年实施的《医药行业改革法案》(AMONG),将创新药品的附加效益划分为6个等级,规定如果药品附加效益不被接受,则将该药划入参考价格组,附加效益的判断标准包括全因死亡率、发病率、健康相关生命质量和不良反应4个指标。同时《社会法典》第五部(SGB V)规定只有专利药品的参考价格组应至少应包括3种药品。
参考价格组的划分流程包括4个步骤:(1)GKV-SV向G-BA提议建立新的参考价格组或将现有药品纳入已有参考价格组;(2)G-BA药品小组委员会负责讨论并审核提议,然后召集基金会代表、专家、患者等多方参与人举行听证会,做出初步决定;(3)G-BA办公室对药品小组委员会的决策进行评估,根据SGB V第91条的规定编制和汇总草案,包括文件摘要、决策理由和最终决定,并提交至联邦卫生部;(4)联邦卫生部如果无异议,则发布联邦公告,公开信息,确定参考价格组。如果存在异议,则交由药品小组委员会重新讨论和审核提议。[7]
在制定参考价格组的过程中,主要考虑以下标准:(1)解剖学治疗学及化学分类系统(Anatomical Therapeutic Chemical,ATC)。在参考价格系统中,依据ATC-3、ATC-4、ATC-5将药品划分为3个级别。(2)生物等效性和治疗结果相似性。如果药品包含相同的活性物质,同时能够以相同的速度和强度被身体吸收,此类药品形成的参考价格组称为学名药参考价格组,由过专利期的品牌药及其被证明的具有生物等效性的学名药组成。如果药品不具有生物等效性,但常用于治疗相同的疾病和症状,也能形成相应的参考价格组,即“疗效参考价格组”,组中的药品具有相似的治疗效果但不具备相同活性成分。[8](3)药品属性。不同属性的药品需要进行分组处理,如根据给药途径(口服、注射、直肠、经皮等)不同,划分为不同亚组,依据药理动力学分为正常释放制剂和控释制剂等,依据剂型形态分为固态、液态等。然而对于药理动力学与制剂形态上存在差异,但药品疗效不存在显著差异,则不作为划分标准。
| 表1 ATC分类系统举例 |
根据参考价格组划分流程与标准,最终将药品划分为3个级别。其中级别1是具有相同活性成分药品。其中活性成分可以是单一物质,也可由不同活性成分以固定比例组合而成。级别2是药理上和治疗上具有相当活性成分的药品,特别是化学结构类似的药品。级别3为具有同等治疗效果的药品,特别是复方制剂。截至2015年4月15日,参考价格体系中划分了438个参考价格组,包括因药品属性不同所形成的不同亚组,覆盖了33 840种药品包装(表2)。[9]
| 表2 参考价格组划分结果 |
制定参考价格前,GKV-SV应首先确定参考价格组中药品的标准包装。标准包装是由大多数厂商在市场上销售的药品,依据药品规格与包装大小两个方面来确定。例如对于阿昔洛韦片剂,当市场中同时存在200mg/25片、400mg/35片、800mg/35片等多种规格与包装大小组合时,应选择大多数厂商都能提供的组合。如果存在多种组合大多数厂商均能提供,则选择处方量最大的组合为标准包装。[10]
确定标准包装后,需制定标准包装的参考价格。然而德国法律对于参考价格的制定,并没有详细的规则,只进行了概括的描述。即参考价格应充分反映药品价值,保证药品的安全、有效、经济与质量可控。参考价格制定时应充分利用企业经济利润,引发市场的充分竞争,促使厂商提供较为廉价的药品,减轻患者和政府费用负担。SGB V第35条第5段阐明了参考价格的制定原则:(1)标准包装的参考价格不得超过最高价与最低价所形成价格区间的下三分位数;(2)同组药品中参考价格下至少应涵盖20%的处方量。同时市场份额小于1%的药品,不纳入计算范围。[11]为了适应不断变化的市场状况,参考价格每年至少审查一次。参考价格计算如图1所示。

| 图1 标准包装参考价格的制定 |
非标准包装参考价格制定的理念在于药品价格受到规格和包装大小两个因素的影响,其中规格越大或包装数量越多,则价格越高,但价格与规格和包装大小的关系并不满足简单线性关系,而更适合于指数函数形式。[12]因此,对于非标准包装的参考价格需要由下面回归方程计算的结果乘以标准包装的参考价格得到。
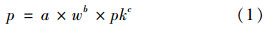
其中p代表相对价格;w代表规格(级别1)和效力比较大小、效力等同因子(级别2和级别3)、效力比较因子(级别3);pk为包装大小;a表示倍增因子,b表示效力指数,c表示包装大小指数。回归系数a、b、c的计算是由非标准包装的市场价格除以标准包装的市场价格获得相对价格p,然后将p、w、pk带入公式ln(p)=ln(a)+b×ln(w)+c×ln(pk),运用最小二乘法计算得到指数a、b、c。同组药品中回归系数是固定的。
对于级别2和级别3的药品,由于活性成分不同,不能直接将规格代入(1)中,而是应针对不同活性成分的限定日剂量进行换算,得出效力比较大小wvg、效力等同因子wäf和效力比较因子wvf替代w代入(1)中。计算公式如下:

其中VG表示比较大小,由联邦联合委员会制定,ÄF和VF由联邦医师和健康保险委员会制定。在制定参考价格时,根据参考价格组中有无非处方药,回归分析时基础价格的选择存在差异。对于有非处方药的参考价格组,基于药房零售价格(AVP)(包括增值税)进行回归分析;对于只有处方药的参考价格组,2012年1月1日前形成的参考价格组,基于药房购买价格(AEP)进行回归分析,2012年1月1日后形成的参考价格组,基于厂商销售价格(APU)进行回归分析。
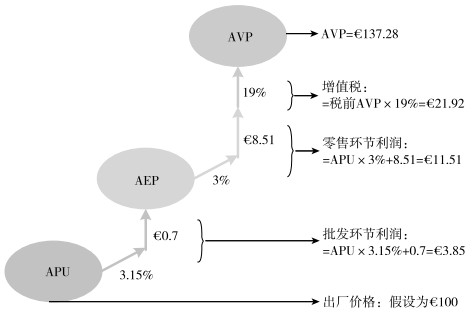
依据上述方法计算出来的参考价格,加上流通环节的利润,方可得到销售终端的参考价格。目前德国对于不予补偿的药品,不限制流通环节利润;对于可补偿的OTC,采用累退加成的方式对流通利润进行规制,如表3所示;对于可补偿的处方药,采用固定加成和比例加成的方式对流通利润进行规制,其中出厂价到批发价的利润为出厂价的3.15%(最大不超过37.8),加上0.7的固定费用,批发价到零售价的利润为出厂价的3%,加上8.51的固定费用,具体计算如图2所示。[13]所有药品的增值税均为19%。
| 表3 可补偿非处方药流通环节利润率 |
| 图2 销售终端参考价格形成方式 |
参考价格体系下的药品,患者需承担药品市场价格高于参考价格的差额,同时需承担部分共付费用。德国根据患者年龄和药品适应症划分为3个补偿类别,首先12岁以下的患者使用的处方药和非处方药可获得100%的补偿,其次12~18岁的患者使用的处方药和治疗特定适应症的非处方药同样可获得100%的补偿,最后对于超过18岁的患者根据药品药房零售价格(包括增值税)pi划分为4种共付方式。[11](表4)
| 表4 患者药品部分负担 |
同时法定医疗保险规定的以下情况可免除部分负担:(1)保险人的部分负担已超过其年收入的2%;(2)慢性病患者治疗慢性疾病的部分负担超过其年收入的1%;(3)18岁以下的儿童;(4)病人购买的药品价格低于参考价格30%;(5)基金协会与厂商签订了免除部分负担合约。同时如果基金协会拒绝补偿某项服务,患者可以向法院控诉基金协会,如果患者能够证明这种服务对于他而言是充分的、适当的和高效的,那么就可以获得补偿。[14]如果医师开具的药品价格高于参考价格时,医师有责任将此信息告知患者,并考虑可供替换的药品。
德国参考价格体系在降低药品价格方面发挥了显著作用,其中Pavcnik通过实证分析1986—1996年间抗糖尿病和抗溃疡两个治疗领域的药品价格数据,证明参考价格体系使品牌药和学名药的价格均产生较大幅度下降。[15]同时在DIMDI网站上公开价格信息有利于消除药品市场的信息不对称,保证患者、医疗机构和医保机构间信息完全,便于利益相关主体的监督。因此在我国放开药品价格管理的背景下,可参照德国模式,从明确支付标准制定部门、划分参考价格组、制定参考价格、进行价格公示以及完善部分负担机制5个方面进行制度设计来构建医保支付标准。但由于药品市场具有不适用于患者“购者自慎”原则、复杂的信息不对称关系、价格需求弹性低等特点,对药品市场采用“一刀切”的支付标准制定方式并不是最优的,需进一步依据患者价格判断能力、药品治疗领域、药品质量、是否需要处方等因素进行市场细分,针对性的选取医保支付标准制定方法。因此可首选非处方药市场或慢性病市场等接近于完全竞争的市场,依据参考价格体系来制定医保支付标准,降低药品市场特殊性和参考价格局限性对患者的影响。
德国基于ATC分类系统、生物等效性和治疗结果相似性、药品属性3个标准将参考价格体系范围中的药品划分为3个等级和不同亚组,包含了专利药与非专利药,处方药与非处方药。但客观存在的问题是不同药品间存在异质性,尤其是不同活性成分药品间异质性更为明显,例如级别2和级别3同组药品间有较大的疗效差异,这意味着患者需要在经济负担和健康风险间进行抉择。[2]因此在我国实施参考定价过程中,在ATC分类标准的基础上,应综合考虑药品生物等效性、剂型、给药途径、质量层级等多种因素对药品进行分组,鉴于药品异质性问题,可首先依据ATC-5划分参考价格组,保证患者用药的公平性。
德国依据药品市场价格分布情况来制定标准包装的参考价格,同时每年至少审查一次参考价格,对降低药品价格,及时反应市场价格起到了积极的作用。在制定我国医保制度标准时,同样应采集药品市场价格,运用科学合理的方法,比如选择中位数、平均数、调和平均值、下四分位数等方式来制定药品支付标准,对于非代表品,由于我国对于不同剂型、规格和包装的药品制定了差比价规则,因此近期仍可采用差比价规则计算非代表品支付标准,长期则可依据回归模型制定支付标准。同时需构建长效动态调整机制,明确支付标准调整原则、调整方法、调整周期及信息公开等内容,进而保证支付标准能及时反映市场信息,减少药品市场价格与支付标准的价格差异,提高支付标准管理的科学性和透明性。
根据OECD数据显示,从2001—2012年德国药品费用占卫生总费用的比值稳定在13%~15%,并且近年来呈下降趋势,表明参考价格体系结合部分负担机制以及其它配套机制,对于控制德国药品费用起到显著的效果。我国基本医疗保险制度对医药费用起付标准、最高支付限额和报销比例进行了明确规定,由于医疗保险减免了个人所需支付的医疗费用,患者倾向于获取比自付全部医疗费用时更多的消费量,致使药品需求弹性下降,在一定程度上影响了医保基金的合理配置。因此在构建医保支付标准过程中,需进一步完善部分负担机制,结合定率负担和定额负担,明确医保—医院,医保—患者的费用结算方式,合理制约医保、医院和患者三方的行为,均衡各方利益,进而规避患者和医疗机构道德风险行为,提高药品价格需求弹性。
| [1] | 董文勇. 德国社会医疗保险用药费用控制制度及其对中国的启示[J]. 环球法律评论, 2006, 28(2): 208-217. |
| [2] | 常峰, 张子蔚. 国外药品参考定价研究综述[J]. 河海大学学报: 哲学社会科学版, 2009, 11(2): 51-54, 92. |
| [3] | 常峰, 张子蔚, 赵雪松. 国内外药品价格规制政策述评[J]. 价格理论与实践, 2009, 29(4): 49-50. |
| [4] | G-BA. Reference prices and how they are set [EB/OL]. [2015-01-23]. https://www.g-ba.de/institution/themenschwerpunkte/arzneimittel/festbetrag/ |
| [5] | G-BA. Decisions on Healthcare Benefits[EB/OL]. [2014-10-23]. http://www.english.g-ba.de/structure/ |
| [6] | Paris V, Docteur E. Pharmaceutical pricing and reimbursement policies in Germany[R]. Organisation for Economic Co-operation and Development, 2008. |
| [7] | G-BA. Arzneimittel-Richtlinie[EB/OL]. [2015-03-11]. https://www.g-ba.de/informationen/richtlinien/anlage/7/ |
| [8] | Petkantchin V. Economic effects of Germany's reference pricing policy for drugs[J]. Institut économique Molinari, Brussels, 2006: 1-20. |
| [9] | DIMDI. Arzneimittel-Festbeträge[EB/OL]. [2015-04-15]. http://www.dimdi.de/static/de/amg/festbetraege-zuzahlung/festbetraege/index.htm |
| [10] | 姚东宁, 邵蓉. 德国药品参考定价制度对我国的启示[J]. 价格理论与实践, 2014, 34(9): 58-60. |
| [11] | Herr A, Suppliet M. Pharmaceutical prices under regulation: Tiered co-payments and reference pricing in Germany[M]. DICE Discussion Paper, 2012. |
| [12] | Danzon P M, Ketcham J D. Reference pricing of pharmaceuticals for Medicare: evidence from Germany, The Netherlands, and New Zealand[C]//Forum for Health Economics & Policy. 2004. |
| [13] | G-BA.Arzneimittelpreisverordnung(AMPreisV)[EB/OL]. [2014-03-27]. http://www.gesetze-im-internet.de/ampreisv/BJNR021470980.html |
| [14] | European Commission, Health and Consumer Protection Directorate-General and Austrian Ministry of Health, Family and Youth. Germany Pharma Profile[R]. Pharmaceutical Pricing and Reimbursement Information, 2008. |
| [15] | Pavcnik N. Do pharmaceutical prices respond to potential patient out-of-pocket expenses?[J]. RAND Journal of Economics, 2002, 33(3): 469-487. |
(编辑 薛 云)





