“竞价分组”概念源于药品集中采购。2015年2月9日,国务院《关于完善公立医院药品集中采购工作的指导意见》(国办发〔2015〕7号)(以下简称7号文)首次提出集中采购要建立药品竞价分组,划分质量层次,确保药品质量。随后,国家卫生计生委《关于落实完善公立医院药品集中采购工作指导意见的通知》(卫药政发〔2015〕70号)(以下简称70号文)对竞价分组进行更加明确的规定。现阶段,药品竞价分组已初见成效,各省竞价分组体系基本建立。
近年来,随着医疗水平的不断提升,医用耗材(以下简称耗材)的发展势头迅猛,已有赶超药品的趋势[1]。2001—2014年,我国耗材市场销售规模增长了约14.28倍,年均复合增速为22.69%[2],已高于药品年均约20%的增幅[3]。但其改革推进相对迟滞,严重阻碍了耗材的发展,导致耗材价格虚高、质量监管缺乏、质量参差不齐等一系列问题。为解决上述问题,国家出台多项政策文件完善耗材集中采购制度。其中,《“十三五”深化医药卫生体制改革规划》(以下简称“十三五”卫生规划)和《国务院深化医药卫生体制改革领导小组关于进一步推广深化医药卫生体制改革经验的若干意见》(厅字〔2016〕36号)(以下简称若干意见)等明确提出,开展高值医用耗材、大型医疗设备集中采购,规范和推进高值医用耗材集中采购。作为耗材采购的主要环节,建立完善质量控制体系对耗材采购改革的推进发挥重要作用。因此,本文选择与质量控制关系最为密切的竞价分组进行研究,分析制度需求,提出相应的解决方案。
1 资料与方法 1.1 资料来源以“医用耗材”、“高值耗材”、“质量层次”、“采购”等多个关键词在中国知网数据库(CNKI)、万方数据库、Google学术、Science elsevier数据库、Springerlink数据库等进行组合检索,共收集相关性较高的文献72篇(中文57篇、外文15篇)。整理国家及各省市最新的医用耗材采购文件,统计竞价分组实践情况。同时,组织参与一系列集中采购政策相关会议、调研(表 1),收集各方意见建议,为完善竞价分组方案提供参考。同时,对比研究医用耗材与药品差异,总结分析医用耗材竞价分组现存问题和经验。
| 表 1 资料的调研采集信息情况 |
本文主要使用文献分析、专家访谈、汇报研讨等研究方法完善医用耗材竞价分组方案。
2 医用耗材实施竞价分组的必要性 2.1 竞价分组的作用与意义竞价分组是指根据一定的指标(如质量属性、注册状态、生产企业资质等),将耗材或药品划分为不同竞价组,同组展开价格竞争,实现“优质优价”目标的一种质量评价方法。[4]其主要作用包括以下三个方面:(1)区分质量层级。通过设置竞价组划分标准,将质量较好的耗材或药品置于较高组别,其他则归入较低组别的方式实现区分质量层次的目的。(2)经济技术标评审的主要依据。无论是药品还是耗材,现阶段竞价分组中的指标大多直接成为药品经济技术标评审或耗材综合评审体系中的重要指标。(3)鼓励研发创新。就药品而言,专利药品、原研药品、实力或资质较强企业的药品等均能处于较高的组别,对于企业进入商务标议价并最终中标都有较大帮助。同样,通过CE、FDA认证的耗材置于较高组别,也有利于鼓励企业提高生产研发水平。
2.2 耗材更需要严格的质量控制措施药品的质量评价以有效成分、辅料、制备工艺考察为主,利用生物等效性、体外溶出度评价等化学方法为主,质量评价较为容易。与药品相比,耗材质量评价更加复杂。首先,耗材的种类更多、规格更复杂,评价工作量更大。[3]其次,同类别耗材的质量要求可能存在差异。[5]最后,医用耗材多以耗材、设备为主,这些产品的特点决定了其质量评价方法应多以物理方法或资料审查等间接评价为主,但这些评价方法在反映耗材质量方面作用有限。[6]
2.3 耗材质量上市前缺乏质量评价体系目前,我国耗材的审评审批主要依据《医疗器械注册管理办法》(国家食品药品监督管理总局令第4号,以下简称《管理办法》)。《管理办法》要求第二、三类耗材需进行临床试验评价其质量,但并未说明临床试验的标准、方法、机构等内容[7],导致审评审批过程存在严重的质量隐患。2016年3月,国家食品药品监督管理总局和国家卫生计生委联合发布《医疗器械临床试验质量管理规范》 (国家食品药品监督管理总局中华人民共和国国家卫生和计划生育委员会令第25号),虽在试验的方案制定、数据来源、试验过程等方面进行规定,但仅对单个试验对象质量的评价进行规定,缺乏同品种质量一致性评价的规定[8],很难解决耗材质量参差不齐的问题。
2.4 耗材质量层次问题严重现阶段我国药品质量层次不齐,“仿标准、不仿质量”的现象依旧存在。对于耗材而言,质量问题同样突出,甚至比药品更加严重。首先,同类型耗材中既有通过FDA和(或)欧盟认证的产品,也有仅符合我国现行审评审批标准的产品,生产厂家既有大型跨国企业也有中小型公司,故在临床质量方面较难保证一致。如对国产和进口白细胞滤器的全血过滤作用进行比较,进口滤器在白细胞去除率和免疫细胞滤过率方面显著优于国产滤器,且滤膜亲水性好、操作更加简便、过滤效果更高,证明进口滤器质量明显优于国产滤器。[9]其次,现阶段存在同一品种规格的耗材对应多个注册批文、多个生产厂家的情况,如常见的隐形眼镜(亲水性),共有446个国产批文,303个进口批文,生产企业近150多家①,由于企业研发、生产能力差异所引起的质量层次问题同样严重。
① 数据来源于国家食品药品监督管理总局网站
2.5 分组体系尚未建立,现有标准过于简单目前,无论从国家层面,还是各省市层面,尚无建立耗材竞价分组相关内容,仅广东、福建、宁夏等11个省份在采购文件中提出了简单的分组要求(表 2)。同时,大部分省市以来源或认证情况作为分组标准,难以真实反映耗材质量情况。如部分省市采购过程中进口组耗材既包含欧美日等发达国家产品,也包含印度、泰国等非发达国家产品,而该部分产品的技术含量、材质等方面甚至不如国产产品,仍将此类产品划分为进口组显然与区分质量层次的目的相悖[10]。
| 表 2 我国各省医用耗材(或高值耗材)竞价组划分情况(截至2017年4月) |
7号文、70号文等政策文件出台后,各省市参照国家要求,在一年内基本形成我国药品竞价分组体系(表 3),无论是竞价组设置还是分组标准均进一步统一和完善。从实践来看,现阶段我国竞价组集中在2~4这一范围内,解决了竞价组过多或者过少所造成的药品质量评价结果差异较大、无法形成充分竞争等问题。[11]同时,在分组标准中纳入“通过质量一致性评价的仿制药品”等指标,能够较好的反映药品质量情况[12],增强了药品竞价分组在质量区分方面的作用。本文认为,可借鉴药品实践思路,在设计耗材方案时集中竞价组范围,增加真实反映耗材质量的指标。
| 表 3 27省招标采购药品竞价组划分情况(截至2017年3月) |
现阶段域外国家基本将耗材质量评审置于审评审批环节,即耗材上市前质量评审工作均已完成,上市后的耗材可确保质量一致性,因此域外不存在同品种耗材质量层次问题。本文选取两种典型的域外质量评审模式进行分析,以期为我国耗材竞价分组的完善提供借鉴。
3.2.1 按照临床使用风险和复杂程度进行耗材分类与药品不同,国际上现行的耗材分类标准主要包括耗材的临床使用难易程度、患者接受治疗的风险高低、对人体造成伤害的大小等,以体现耗材内在属性。因此,各国均制定相应的分类标准,目前多为三类。如美国将耗材划分为Ⅰ、Ⅱ、Ⅲ三个等级,欧盟将耗材划分为Ⅰ、Ⅱa、Ⅱb、Ⅲ四个等级[13],我国将耗材划分为三大类[14-15]。因此,在制定耗材竞价分组方案的过程中,需考虑其分类特点和内在属性,体现耗材与药品的差异性。
3.2.2 实质等同性决策实质等同决策(Substantial equivalence process,SE)是指新耗材注册申请过程中,要求企业自行选择与待评价耗材①在用途、基本特点(如设计、用料)和安全性、有效性评估结果相同的已上市耗材,由FDA医疗耗材与放射健康中心(Center For Devices And Radiological Health,CDRH)验证待测耗材与所选耗材上述指标情况是否保持一致,根据验证结果划分耗材等级、确定耗材质量和是否上市的决策过程。[16]根据美国《联邦食品、药品和化妆品法案》第510条(k)项(以下简称510(k))规定,一个申请上市的耗材必须通过SE,主要包括标准耗材②选择、临床数据确定、用途、基本特点(设计、用料等)审查、安全性审查、有效性审查、决策结果公布六个核心环节,而审查过程又划分为9个具体步骤,每个步骤检验一个方面,从资料到数据,从定性检验到定量检测,最终以决策证书的形式公布决策结果。[17]作为证明耗材质量是否合格、临床是否安全有效的重要参考,SE现普遍适用于美国各类医用耗材注册审评过程中。
① 待评价耗材即企业申请注册审评的耗材
② 标准耗材是指由FDA规定的,作为医用耗材评审标准的已上市耗材,作用同仿制药一致性评价中的参比制剂类似
3.2.3 第三方独立机构临床评估与美国相比,欧盟更加注重耗材的临床情况。首先,欧盟的耗材质量评价主要依据耗材临床评价指南(Guidelines on the Clinical Evaluation of Medical Devices,GCEMD),明确提出耗材的质量需进行临床评价,通过分析安全性数据、性能数据等得出结论。其次,指南对临床评价进行了详细规定,设置数据收集整理、临床数据评价、临床数据分析三个评价阶段,选择Meta分析作为评价耗材安全性、有效性的研究方法,以授权书的形式告知企业评价结果。[18]需要特别说明的是,欧盟的耗材质量评价工作均由政府管辖的第三方独立机构进行,如法国的G-MED公司和英国的劳埃德质量保证公司(Lloyds Register Qualitys Assurance,LRQA)等,这些耗材认定机构在欧盟的耗材质量评价中发挥重要作用。[19]
综上,鉴于美国和欧盟耗材质量评审体系较为完善,评审标准相对较高,评审过程较为严格,因此应当在我国耗材竞价分组方案中将通过美国、欧盟等国家注册审评的耗材置于较高的竞价组,保证质量区分。同时,应参考域外经验,加快完善我国医疗器械审评审批制度,建立质量一致性评价体系,逐步解决耗材质量参差不齐的问题。
4 竞价分组方案初探考虑到我国耗材竞价分组体系尚未建立,耗材质量审评有待完善的现状,本文参考药品竞价分组发展思路后,认为我国耗材竞价分组方案亦可按照“三阶段”的模式发展[4],同时,需重点考虑耗材与药品间的差异性。
4.1 现阶段:完善现有方案,丰富指标体系鉴于耗材自身属性差异较大的特点,在制定竞价分组的过程中需要按照不同类别制定不同的竞价组层级和分组标准。参考域内外对耗材的分类情况,现阶段可遵循“先分类、再分组”的原则,以广东耗材竞价分组标准为基础,重点参考各省现有耗材分组指标体系③,制定简洁、可行、操作方便、具有一定质量区分作用的竞价分组体系。
③ 参考省份为广东、福建、宁夏、湖南、江苏、青海、山东、广西、河北、湖北、江西
需要特别说明的是,方案中所有的指标均为各省市耗材采购方案中使用的指标,其科学性、合理性已通过专家论证。同时,这些指标均为各省市使用频次较高的指标,如此设计有利于今后全国统一耗材竞价分组标准。
4.1.1 第一类耗材的竞价方案由于第一类耗材(即域外Ⅰ等级耗材)的临床使用风险较低,多为安全性可以保障、对人体危害较小的耗材,其竞价组划分标准仅需保证耗材具有相关检测即可,具体情况如表 4所示。根据现阶段我国耗材(广东)及药品竞价分组实践情况,划分3组较为常见。同时,在初定3个竞价组的基础上,又增加“其他产品”这一竞价组,以应对由于耗材差异性较大所带来的问题。参考药品竞价分组,有87.5%的省份将此项指标纳入竞价分组中,证明产品的创新程度、获奖情况能在一定程度下反映产品质量,是目前划分竞价组的主要指标。同时,根据耗材现有采购方案,已有33.3%的省市将专利、获奖情况作为耗材质量相关指标纳入采购综合评审体系中。因此,在原有指标的基础上增加了“拥有发明专利的产品”和“获得国家级奖项的产品”两个新指标。
| 表 4 第一类耗材竞价分组标准 |
相比第一类耗材,第二、三类耗材(即域外的Ⅱ、Ⅱa、Ⅱb、Ⅲ等级耗材)无论是临床使用风险还是对人体危害都相对较高,决定了该类耗材在质量方面需要制定更高的标准进行控制,具体情况如表 5所示。
| 表 5 第二、三类耗材竞价分组标准 |
首先,结合药品实践,保证充分竞争和质量区分,初步设置三个竞价组,即表 5中1~3组。之后,考虑到第二、三类耗材对于质量较高的要求,为加强质量区分作用,将竞价组增至5个。
参考美国和欧盟的实践经验,通过实质等同性评估或欧盟第三方临床评价的耗材,具有较高的质量水平和临床效果,故在第一组中增加“通过欧盟临床评估或美国实质性等同评估的进口产品”这一指标能够凸显质量较优的产品。
根据统计结果,各省市均将“质检结果”纳入耗材综合评审体系中,表明该指标能够在一定程度上反映耗材质量情况;根据调研和电话访谈的结果来看,“进口转国产耗材”虽产品质量方面具有较好的优势,但与3类仿制药类似,其在竞价分组实践中往往得不到足够重视。[4]因此,将“质检结果”与“进口转国产耗材”两项内容纳入第二组。
虽然企业资质类指标无法直接证明产品质量,但由于我国耗材审评审批体系尚未改革,能够直接反映耗材质量的指标并不多。同时,因企业资质类指标已成为各省市评审体系的重要组成部分,因此参考各省实践,在第三、四组纳入部分企业资质类指标,有利于现阶段耗材竞价分组体系的完善。
4.2 过渡阶段:细化评价指标,重点注重内在指标由于我国现阶段耗材注册审评过程对质量的评估方法有待完善,同类耗材品种繁多,规格各异,很难利用类似认证情况或企业资质等外围指标区分质量层次,因此,需要寻找能否更好的反映耗材质量的指标,本文将这类指标定义为内在指标,内在指标的制定是耗材竞价分组过渡阶段最为重要的工作。
考虑到不同耗材无论从材料、工艺技术要求、临床使用情况等均具有较大差异性。因此,内在指标需按照耗材的适用症状进行分类(如心血管支架、骨替代材料等),每类耗材制定详细的内在指标体系,并赋予一定的分值,每一个得分区段对应一个竞价组,根据每个耗材的得分情况,将其纳入相应的竞价组中。如考察心血管支架性能的指标有弹性模量、屈服强度、拉伸强度和示踪性[20],根据不同指标特性赋予相应分值,形成内在指标体系,并设计内在指标评分方式(公式如下)。划分得分区段,并与竞价组一一对应,根据耗材评分情况将其归入相应的竞价组。
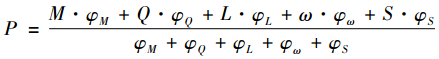
|
其中,M表示支架材料,Q表示弹性模量,L表示屈服强度,ω表示拉伸强度,S表示示踪情况,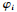
比较单纯使用外围指标确定竞价组的方式,利用耗材的内在属性指标对其质量进行评价,通过质量情况划分竞价组的方法更加科学、合理,也能充分体现耗材与药品的差异性。
4.3 未来趋势:建立科学、合理的质量审评体系同药品类似,竞价分组作为现阶段及过渡时期的权宜之计,终将被逐渐替代。因此,待耗材质量评估体系完全成熟,未来耗材的质量审评工作将在上市前全部完成,通过审评审批的耗材将在质量方面确保一致性,采购阶段可充分发挥“带量采购”的优势,更好的控制药品价格。基于药品改革经验[4],按照“两步走”的思路推进未来我国耗材质量评估建设:
第一步可按照“由点及面”的思路,先选取几个临床用量较大、患者和医生关注度较高的耗材作为试行品种进行实践。在质量评估环节,依托试行品种探索较好的质量评估流程,同时需注意耗材差异性问题,建立质量分类评估体系,建议重点借鉴美国实质等同性决策经验。在采购环节,积极探索耗材竞价议价方式,丰富竞价议价依据。各省市需建立专家库,便于竞价议价过程可随机形成价格委员会,保证结果相对专业的同时,也保证过程的公平、客观。
第二步待试点品种全面推行后,可以此为据制定耗材的具体操作方案,全面推广上述质量评估及采购模式。
| [1] | 段旭芳, 谢大志. 医疗器械行业发展和投资策略研究[J]. 华南理工大学学报(社会科学版), 2012, 14(5): 36–43. |
| [2] | 中国产业信息网: 2001-2014年中国医疗器械市场规模发展情况[EB/OL]. (2017-03-25)[2017-05-10]. http://www.chyxx.com/industry/201507/331271.html |
| [3] | 刘云云. 面向集中招标采购的基本高值医用耗材品种遴选研究[D]. 武汉: 华中科技大学, 2012. |
| [4] | 丁锦希, 董锐, 李伟, 等. 我国药品集中采购制度"竞价分组"政策的评价与思考-基于2016年各省集中采购方案的统计分析[J]. 中国卫生政策研究, 2016, 9(9): 52–59. |
| [5] | 何芬华. 四川省医用耗材集中采购综合评价指标体系研究[D]. 成都: 成都中医药大学, 2012. |
| [6] | 鲁路, 邵蓉. 浅议高值医用耗材集中采购[J]. 齐鲁药事, 2008, 27(3): 181–183. |
| [7] | CFDA: 《医疗器械注册管理办法》(国家食品药品监督管理总局令第4号)[EB/OL]. (2017-03-27)[2017-05-10]. http://www.sda.gov.cn/WS01/CL0053/103756.html |
| [8] | CFDA: 《医疗器械临床试验质量管理规范》(国家食品药品监督管理总局, 中华人民共和国国家卫生和计划生育委员会令第25号)[EB/OL]. (2017-03-27)[2017-05-10]. http://www.sda.gov.cn/WS01/CL0053/148101.html |
| [9] | 郭瑞德. 国产与进口白细胞滤器对全血过滤的比较[C]. 浙江省医学会医学检验学分会, 2006. |
| [10] | 茹国英. 医疗制度改革中高值医用耗材价格管理的探索[J]. 财经界(学术版), 2014(19): 72. |
| [11] | 尹明芳, 徐爱军, 梁红云, 等. 医疗机构药品集中采购质量层次划分研究[J]. 药学与临床研究, 2014, 22(1): 5–14. |
| [12] | 冯毅, 朱波. 关于我国仿制药质量一致性评价的研究及建议[J]. 中国新药杂志, 2016, 25(1): 19–26, 41. |
| [13] | Corinna Sorenson, Michael Drummond. Improving Medical Device Regulation:The United States and Europe in Perspective[J]. The Milbank Quarterly, 2014, 1(92): 114–150. |
| [14] | 国务院: 《医疗器械监督管理条例》(国务院令第650号)[EB/OL]. (2017-03-27)[2017-05-10]. http://www.sda.gov.cn/WS01/CL1100/97814.html |
| [15] | CFDA: 《医疗器械分类规则》(国家食品药品监督管理总局令第15号). [EB/OL]. (2017-03-27)[2017-05-10]. http://www.sda.gov.cn/WS01/CL1101/124222.html |
| [16] | The 510(k) Program: Evaluating Substantial Equivalence in Premarket Notifications[510(k)] [EB/OL]. (2017-04-01)[2017-05-10]. http://101.96.10.42/www.fda.gov/downloads/medicaldevices/deviceregulationandguidance/guidancedocuments/ucm284443.pdf |
| [17] | The 510(k) Program: Evaluating Substantial Equivalence[510(k)] [EB/OL]. (2017-04-05)[2017-05-10]. http://101.96.10.42/www.fda.gov/downloads/medicaldevices/deviceregulationandguidance/guidancedocuments/ucm284443.pdf |
| [18] | Management of Medical Devices Policy Medical DevicesProcedures V7. 0[EB/OL]. (2017-04-05)[2017-05-12]. www.dbh.nhs.uk/Library/Corporate_Policies/CORPPROC4v5 |
| [19] | 陈志刚. 欧共体医疗器械管理和质量认证印象[J]. 医疗装备, 1998(6): 17–21. |
| [20] | 孙建红. 镁合金心脏血管支架结构设计及性能[D]. 沈阳: 沈阳工业大学, 2015. |
(编辑 赵晓娟)




